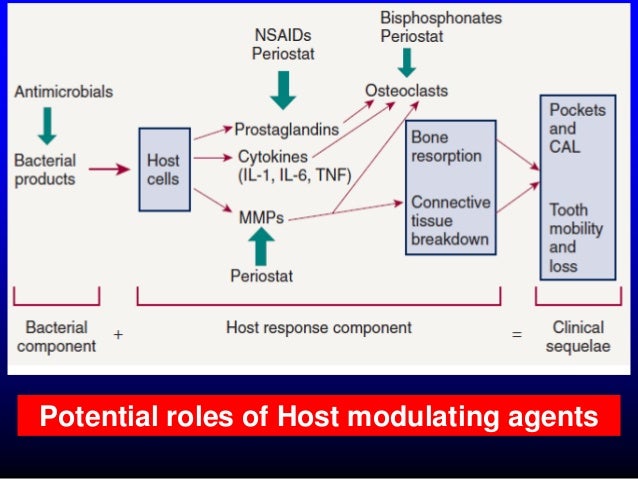
Tämä on sitaatti netistä ja viittaa kirjaan. Suomennan kappale kappaleelta
Learn more about Matrix metalloproteinase
Matrix
metalloproteinases (MMPs) are a family of highly homologous protein
degrading zinc dependent endopeptidases that break down components of
the extracellular matrix.
From:
Advances in Pharmacology, 2012http://www.sciencedirect.com/topics/medicine-and-dentistry/matrix-metalloproteinase
1. Matrix Metalloproteinase 3/Stromelysin 1
Hideaki Nagase, in Handbook of Proteolytic Enzymes (Third Edition), 2013
Distinguishing Features
(kts. suomennos 3.1. 2018 : Lisätieto stromelysiineistä ST-1, -2)
2. Matrix Metalloproteinase-11/Stromelysin 3
Marie-Christine Rio, in Handbook of Proteolytic Enzymes (Third Edition), 2013
Name and History
(kts. suomennos 3.1. 2017 : Lisätieto stromelysiineistä, ST-3)
3. Molecular Biology of Head and Neck Cancer
David K. Lam, Brian L. Schmidt, in Current Therapy In Oral and Maxillofacial Surgery, 2012
Matrix Metalloproteinases
Matrix metalloproteinases (MMPs), or zinc metalloenzymes involved in extracellular matrix remodeling, consist of the collagenases, gelatinases, stromelysins, stromelysin-like MMPs, membrane-type MMPs,
and new MMPs. Malignant cells may use MMPs to dissolve the basement membrane and degrade interstitial stroma to facilitate invasion and metastasis. MMP-2 expression is higher in cell nests of metastatic tumors than in those of non-metastatic tumors in oral cancer, thus suggesting that MMP-2 is a marker predictive of metastasis.
142,143
MMP-3, MMP-10, and MMP-11(stromelysiinit) have also been implicated in the progression of oral cancer.144,145
Read full chapter
4. Matrix Metalloproteinase 23
Duanqing Pei, in Handbook of Proteolytic Enzymes (Third Edition), 2013
Name and History
Matrix metalloproteinase 23 (MMP-23) is the first type II transmembrane matrix metalloproteinase described
in the matrix metalloproteinase family [1]. It has been isolated from multiple species including human,
mouse and rat [2–5]. The first evidence of its sequence was reported by Gururajan and colleagues [2]
describing the identification of two MMPs genes named MMP-21 and MMP-22 in duplicate within human chromosome
1p36.3 region frequently implicated in tumor suppression. However, these numbers had previously been assigned
to other MMPs. Subsequently, a human cDNA was isolated and named MMP-23; this had almost identical sequence
to the reported MMP21/22 [5]. The mouse cDNA was isolated and named CA-MMP (Cysteine Array MMP) based on
structural features [4]. The same gene has also been identified in the female reproductive systems of human
and rat and named MIFR/Femalysin accordingly [3]. The name MMP-23 has been officially recognized as the
serial designation within the MMP family [6].
Read full chapter
5. Viruses Responsible for Hemorrhagic Fevers
Vivian Vasconcelos Costa***†, ... Mauro Martins Teixeira**, in Vascular Responses to Pathogens, 2016
Matrix Metalloproteinases
Matrix metalloproteinases (MMPs) or matrixins are proteases that break extracellular matrix (ECM)
and proteins that lay out the ECM, while the tissue inhibitor of matrix metalloproteinases (TIMPs)
block the activity of these MMPs and prevent the destruction of ECM. Thus, the balance between MMPs and TIMPs
is critical for the eventual ECM remodeling in the tissue 122 and these molecules have shown important
roles in many physiological and pathological conditions.123 In this context, Luplertlop et al. showed
that DENV infection of immature dendritic cells (iDCs) led to overproduction of soluble matrix metalloproteinases MMP-9 and MMP-2
and that these enzymes were capable of enhancing endothelial permeability of HUVEC monolayer cells in vitro and
in a model of vascular permeability in vivo.84 Of note, MMP-9 production was enhanced in patients with DENV infection
and was associated with severity of disease.85 Indeed, elevated levels of MMPs and their correlation with
severe disease do not appear to be exclusive to DENV infections. Genome-wide host expression patterns
in spleen or blood samples from mice and nonhuman primates, respectively, infected with Ebola virus
revealed a positive correlation between the dysregulated inflammatory responses associated with induction
of specific MMPs and the lethal outcome of Ebola.86,87 Interestingly, Aydin et al. showed that during the
acute phase of disease, severe CCHF-infected patients presented higher serum levels of the tissue inhibitor
of MMPs (TIMP-1) than nonsevere patients. Indeed, severe patients also revealed enhanced levels of MMP-1, 7, 9, 10
during the convalescence phase, suggesting that the imbalance between these molecules plays a role
in the pathogenesis of CCHF.88
Read full chapter
6. Angiogenesis and Anti-Angiogenesis Strategies in Cancer
Shaker A. Mousa, Paul J. Davis, in Anti-Angiogenesis Strategies in Cancer Therapeutics, 2017
Matrix Metalloproteinases
Matrix metalloproteinases (MMPs) are zinc-dependent endopeptidases that degrade ECM proteins—collagen, laminin,
and fibronectin—during the process of cancer invasion and metastasis. MMPs are produced primarily by
reactive stromal and inflammatory cells surrounding tumors rather than by cancer cells.
Hydroxamic acid-derived inhibitors of MMPs are orally bioavailable. Limited efficacy of
this class of agents in clinical trials against a variety of solid tumors prompted termination
of clinical trials [33,34]. MMPs are also essential to angiogenesis, preparing the tumor microenvironment
for the expansion of tumor blood supply.
Read full chapter
7. Vascular Smooth Muscle
Lula L. Hilenski, Kathy K. Griendling, in Vascular Medicine: A Companion to Braunwald's Heart Disease (Second Edition), 2013
Matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases
Matrix metalloproteinases are zinc-containing enzymes that, along with extracellular proteases
in the plasminogen activation system, induce remodeling of VSMC cell-matrix and cell-cell interactions
(reviewed in92–94) and release ECM-bound growth factors, cytokines, and proteolyzed ECM fragments,
or “matrikines,” with cytokine-like properties into the ECM. Members of the MMP family found
in vascular tissues (listed in Ref. 95) include interstitial collagenases, basement membrane gelatinases,
stromelysins, matrilysins, and membrane type (MT)-MMPs and metalloelastase (see Chapter 4).
In the vascular wall, production of pro-MMP-2, MMP-14, and TIMP-1 and -2 is constitutive,96
while other MMPs can be induced by inflammatory cytokines (interleukin [IL]-1 and -4 and tumor
necrosis factor α [TNF-α]), hemodynamics, vessel injury, and ROS.93 In addition, MMPs can act
synergistically with growth factors such as PDGF and FGF-2.
Matrix metalloproteinase induced remodeling of basement membrane components laminin,
polymerized type IV collagen, and HSPGs promotes a VSMC migratory phenotype.
In addition, MMP cleavage and shedding of non-matrix substrates—in particular,
adherens junction cadherins—act to remove physical constraints on cell movement.93
Furthermore, ECM remodeling enables integrin signaling from the cell surface to focal adhesions,
modulating cell cycle components cyclin D1 and p21/p27 CDKIs.96
In vascular remodeling, MMP activities are tightly regulated at several levels:
transcriptional level, activation of pro-forms, interaction with specific ECM components,
and inhibition by TIMPs. Modulation of MMP activity is evident in VSMC migration and neointima formation
after injury, plaque destabilization in atherosclerosis, aneurysm formation, hypertension, and coronary
restenosis.95
In atherosclerosis, MMPs have potential either to promote plaque instability, as in
advanced plaques of hypercholesterolemia models, or to stabilize plaques by increasing VSMC migration/proliferation.
Up-regulation of MMPs in VSMCs may contribute to aneurysm formation.3
Read full chapter
8. Neuroprotection: Where Are We Going?
Gary H. Danton MD, PhD, W. Dalton Dietrich PhD, in From Neuroscience To Neurology, 2005
Matrix Metalloproteinases (Table 14.3)
Matrix metalloproteinases (MMPs) are angiogenic enzymes that break down components of the
extracellular matrix. Although angiogenesis seems like a potential benefit,
MMPs may enhance BBB breakdown after stroke and increase inflammation. MMP inhibitors
such as batimistat (BB-94) and KB-R7785 decreased infarct volume in mice following permanent
focal ischemia (Asahi et al., 2000; Jiang et al., 2001). BB-1101 reduced edema 24 hours after
focal ischemia in rats and reduced hemorrhage in both rats and rabbits (Rosenberg et al., 1998;
Lapchak et al., 2000; Sumii et al., 2002). MMP
inhibitors have been evaluated in patients for their antiangiogenesis properties in cancer treatment
and are well tolerated in patients (Hidalgo and Eckhardt, 2001).
Read full chapter
9. Matrix Metalloproteinases in Biologic Samples
Gregory T. Jones1, in Advances in Clinical Chemistry, 2014
Matrix metalloproteinases (MMPs) are a subfamily of the metzincin superfamily
of endogenous proteinases [1–3]. MMPs typically consist of a propeptide domain,
a catalytic metalloproteinase domain, a linker (hinge region) peptide, and a hemopexin domain [1].
Common structural features consist of a zinc-binding motif (HEXXHXXGXXH) within the catalytic domain
and a cysteine switch motif (PRCGXPD) within the propeptide domain [4] (Fig. 7.1).
The binding of these domains to the catalytic zinc ion keeps the proenzyme in an inactive state
by preventing water molecule binding, required for catalysis, to the zinc ion [1].
Understanding the nature of these activation states is key to interpreting any methodological
technique that attempts to measure MMP activity.
Read full chapter
10. Diagnostic Techniques in Ocular Surface Disease
Bennie H. Jeng, in Ocular Surface Disease: Cornea, Conjunctiva and Tear Film, 2013
Rapid Testing For Inflammatory Markers
Matrix metalloproteinase 9 (MMP-9) plays a critical role in wound healing
and inflammation, and is primarily responsible for the pathologic alterations
to the ocular surface in various conditions.36
MMP-9 has been demonstrated to be significantly elevated in the tears of patients
with blepharitis, allergic eye disease, dry eye disease, and conjunctivochalasis.37,38
The ability to test for MMP-9 in the tear film may prove to be an important tool to help
in the diagnosis of ocular surface disease. Recently, a commercially available
point-of-care test, RPS InflammaDry Detector (RPS, Inc, Sarasota, FL, USA) offers
an easy-to-administer and rapid turn-around test (10 minutes) for measuring MMP-9 levels in the tear film.
Read full chapter